Cuando papá y mamá se aman un montón, o cuando el preservativo se rompe una noche de verano, o cuando en el laboratorio una pipeta está cargada con semillitas, todos sabemos lo que pasa: un nadador olímpico espermatozoico vence heroicamente a otros cientos de millones, encuentra al óvulo y ambos se fusionan formando una única célula. De ahí van a surgir más de 30 billones de células que forman a un organismo, que son lo que son y hacen lo que hacen. Esta es la historia de cómo, para llegar a ser eso, tienen que renunciar a poder ser.
La primera célula que se forma en la fecundación tiene la potencialidad de ser cualquier tipo de célula. Pero hay una regla: una vez que se transformó, no puede volver para atrás. Es un proceso que sólo va en una dirección; hay un principio y un fin claro. A medida que se divide en dos, cuatro, ocho, estas nuevas células empiezan a tener una identidad más definida, un “linaje”. Así, algunas van a terminar integrando el hígado, otras el cerebro, y otras morirán en el intento. Este proceso se llama diferenciación, donde cada célula obtiene su identidad, su forma, su función, y al final no le queda otra que decir ‘soy lo que soy’.
Lo curioso es que todas las células del cuerpo vienen de una única célula, y si recordamos cómo funciona la división celular, todas tienen copias exactas de la información que las hace ser el organismo que son (sos, somos): su ADN. O sea que en principio parece raro pensar que, partiendo de un punto, llegan a lugares distintos. Sin embargo, la información que decide qué son no es la información que contienen, sino la que expresan. No es lo mismo tener el libro y estudiar el primer capítulo que leerlo todo. Cada célula toma solamente una parte del ADN y lo hace efectivo, pasándolo de información almacenada a información que actúa. Dos tipos de células distintos que contienen exactamente la misma información, van a ser distintas no por contener información distinta, sino por expresar la información que contienen de distinta manera.
Pero, de nuevo, esta diferenciación va para un solo lado. Empezamos en una célula que a medida que se diferencia pierde potencialidad de ser al dividirse, pasando por: totipotente (puede convertirse en todas) → pluripotente (en muchas) → multipotente (en unas cuantas) → célula diferenciada (en ninguna). En el cuerpo humano, con excepción de unas pocas que se mantienen multipotentes, la gran mayoría de nuestras células se diferencian completamente y hasta dejan de dividirse. Es un proceso normal que está buenísimo. Si alguna de esas se vuelve multipotente, puede que empiece a multiplicarse de forma descontrolada al punto que Leo se alinee con Sagitario, con grandes chances de que un cáncer se cruce en tu camino.
Las células madre se estudian hace rato, y esta historia comienza con la idea de tratar de identificar los factores que las definen, que les permiten mantenerse pluripotentes, con la capacidad potencial de ser muchos tipos de células distintos. Así fue que en la tierra del sol naciente, un investigador llamado Shinya Yamanaka interrumpió su búsqueda de Charizard porque se le ocurrió una idea. Su equipo de celulólogos y biocomputólogos había estado trabajando en encontrar las señales exactas asociadas con la ‘maternidad’ de una célula madre.
El experimento consistió en agarrar una plaquita con un montón de agujeritos y tirarle todas las proteínas de un conjunto de células. Lo interesante es que, en cada agujerito, sólo se pega un tipo de proteína, y que además, si ponemos la placa bajo un determinado tipo de luz, ese agujerito se mostrará de un color específico dependiendo de si tiene o no proteína pegada, y cuánto. Estas placas se mandan a pedir, y si bien esto parece una publicidad encubierta, es porque así sabemos exactamente qué proteína se debería pegar en cada agujerito; el fabricante dice ‘en el agujerito A7 se pega tal cosa’. Como una batalla naval pero más proteica. Si vemos luz de color x en el agujerito A7, es porque tiene proteína pegada; sabemos cuál es y podemos comparar qué cantidad hay.
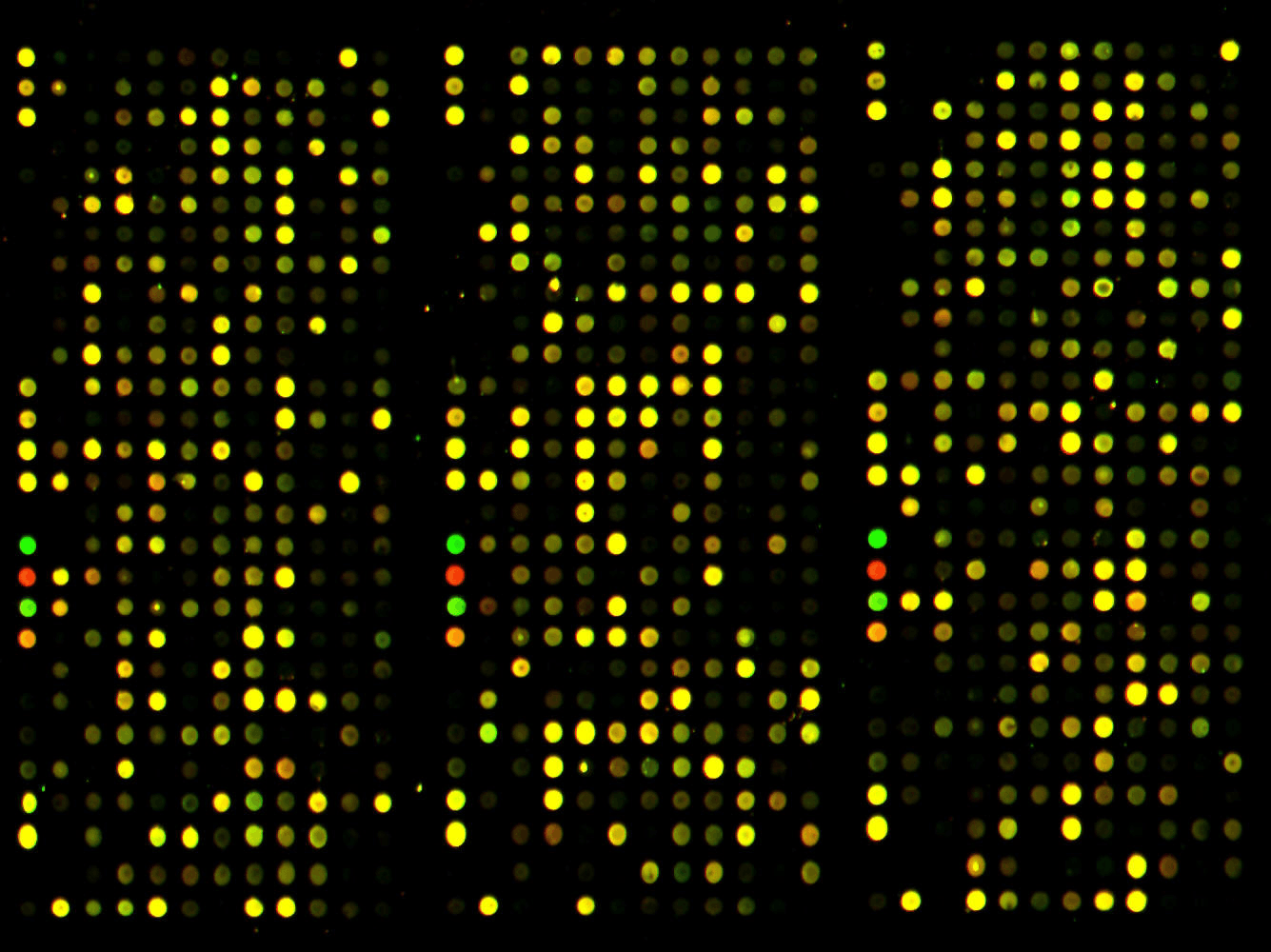
“Lo interesante es que en cada agujerito se va a pegar un sólo tipo de proteína y, si ponemos la placa bajo una determinada luz, ese agujerito se mostrará de un color específico dependiendo de si tiene o no proteína pegada.”
Este método no es sólo la navidad del nerd, además permite comparar patrones de expresión proteica. Yamanaka tomó dos poblaciones celulares de distintos tipos, células madre y diferenciadas, para analizar qué proteínas están más o menos expresadas en cada tipo. Una hermosura. En especial porque después de hacer MUCHOS de estos experimentos y darle duro a la compu, encontraron 24 proteínas que además de estar expresadas de manera distintas en las dos poblaciones celulares en cuestión, regulan la expresión de otras. Estas cosas (proteínas) se llaman factores de transcripción, y son uno de los indicadores para las células de qué parte del ADN leer (y transcribir en ARNm) y qué parte no.
Y ahí fue cuando pensaron ‘Che, si agarramos una célula diferenciada que ya llegó al final de su camino −como un fibroblasto− y le metemos los factores de transcripción que conocemos de células madre, ¿podríamos hacer que esa célula empiece a leer otras partes del ADN y se vuelva pluripotente?’

Después de mucho jugar con genética y virus lograron meter los 24 factores en células diferenciadas en cultivo (estrictamente, pedacitos de ADN que codifica para las proteínas, que las células expresan como si fuese propio), y ¡shhiup! (onomatopeya de desdiferenciación celular), obtuvieron un par de pequeñas colonias de células con cara de madres, a las cuales llamaron ‘células madres pluripotentes inducidas’ o iPSC (induced Pluripotent Stem Cells).
No sé cómo escribir esto para que refleje lo absolutamente genial que es, así que escribo una oración muy fuerte que hay que tomar con pinzas porque no es tan así: digamos que es el equivalente biológico de viajar en el tiempo. Lograron revertir un proceso que naturalmente va para un sólo lado, algo muy sarpado. Pero la cosa no terminó ahí. La ventaja de tener métodos computacionales y experimentales que se complementan, es que podés ver cómo simplificar un sistema que parecía complejo. Después de explorar y poner becarios a trabajar sin parar, simplificaron a que son 4 los factores indispensables para lograr la desdiferenciación. CUATRO cositas que metés en una célula aburrida y se transforma en una célula superpoderosa (o pluripotente, casi lo mismo). Y, obvio, llamaron a esto ‘reprogramación celular’.
Poder transformar piel en neuronas o en células de corazón que laten en el microscopio es increíble. Pero también implica dar luz verde a un campo de investigación con muchísimo potencial. Podemos generar células madres de quien queramos y de donde queramos sin usar embriones de pollitos albinos o molestar la ética de nadie. Todos contentos, lluvia de premios, un Nobel y toda la bola.
Cuando se genera una revolución así, los biólogos moleculares salen al patio a jugar. Lo aplicaron muy bien en células humanas y crearon células madre a partir de lo que se te ocurra. Hasta lograron reprogramar un tipo celular diferenciado en otro directamente sin pasar por pluripotente. En una de estas aventuras lograron, a partir de iPSC de ratones, formar óvulos fértiles que al fecundarlos e implantarlos generaron ratoncitos sanos. Y si bien esto no es lo que pasó con Dolly, estamos hablando de formar óvulos a partir de piel. Obvio que existen muchísimas limitaciones y queda mucho que desarrollar, pero como en toda revolución de calidad, mejores métodos e innovaciones surgen todo el tiempo y el campo se ha vuelto muy competitivo. Poder manipular células de esta manera extiende al infinito punto rojo (+2) las posibilidades para investigación, particularmente en medicina personalizada: desde el testeo de medicamentos en células específicas de cada paciente, la corrección de mutaciones y generación de órganos en 3D sanos del mismo paciente para trasplante, hasta la posibilidad de darles un bebé a quienes no puedan tenerlo. Todo súper futurista pero que de verdad está pasando.
Pero por un ratito tratemos de frenar esa fuerte tendencia que tenemos todos de gravitar hacia los ‘para qué’. Qué masa infinita esconderá nuestra necesidad de transformar el mundo, nuestra urgencia de reclamarnos agentes y no (aunque apasionados) espectadores, que a veces hasta le gana a la maravilla de, ni más ni menos, entender. No sólo pensar en reprogramar una célula como una herramienta. Hay que poder frenar y valorar el hecho enorme de haber examinado, pensado y comprendido la realidad hasta extraer un cómo enorme, no trivial. El cómo revertir un proceso unidireccional, la flecha del tiempo del desarrollo. El cómo hacer un huevo con un omelette.
Los nuevos para qué, cómo y cuánto que se generan ahora llevan a nuevos debates. Estamos hablando de armar vida independiente a partir de células que ya llegaron al final de su camino de diferenciación, y con potencial de convertirse en diferentes tipos celulares, o hasta en todos. Parados acá ¿cuánto falta para que nos preguntemos si hay diferencias entre una primera célula humana generada por fecundación y una que antes era de la piel y que reiniciamos a su estado inicial? ¿Qué diferencia hay entre una primera célula fecundada y esta? El tema de llegar a la esquina del conocimiento y poder cruzar la calle no es solamente el desafío de entender cómo llegar: también es ir tan lejos que tenemos que enfrentar nuevos desafíos éticos, ponernos a prueba y mirar para los dos lados antes de cruzar.
Comprender el camino que sigue un linaje de células abre las puertas a entender nuevos procesos celulares y nos muestra lo imponente que es su funcionamiento. Nos recuerda que el camino de un linaje empezó en algún momento con puro potencial y fue recortando puede ser, porque era la única forma de ser. Una sola célula que se parte y recorta sus opciones, generación tras generación. Un poco de azar y señales de células vecinas llevan a una a dividirse y recortarse hasta que es una célula de la piel. Otra, que empieza su camino en exactamente el mismo lugar, ahora es neurona. Con este nuevo poder, discutamos cómo usarlo. Redefinamos lo que está bien y lo que está mal las veces que sea necesario. Corramos el límite. Apoyemos a quienes luchan por entender más y mejor. Empujemos la barrera de lo posible.
Acá termina esta historia de empezares. La de cómo podemos ir a contramano del desarrollo embrionario y no morir en el intento, o nacer, o lo que sea. La de cómo cumplir a escala celular ese sueño inevitable que cada individuo completo y reflexivo rumió mil veces, ese de dejar de ser y poder volver a ese punto exacto donde las opciones sobran y somos todos los que podríamos haber sido.

